2021年人教版化學九年級下冊 9.3.2溶液的濃度
一、選擇題
1.下列圖象能正確反映其對應操作中各量變化關系的是( )
A.向pH=3的稀鹽酸中不斷加水
B.向接近飽和的硝酸鉀溶液中不斷加入硝酸鉀固體
C.高溫煅燒一定質量的石灰石
D.在部分變質的NaOH溶液中加稀鹽酸
2.有一杯飽和的食鹽水,小剛同學對它進行下列操作,溶質的質量分數發生變化的是( )
B. 倒出一部分
C. 升高溫度
D. 恒溫下,再加食鹽
3.現有一定質量的KOH和K?CO?混合物,測得其中鉀元素質量分數為60%,將其放入90g稀HCl中恰好完全反應,得到100g不飽和溶液和3g氣體,則所得溶液中溶質的質量分數是( )
A. 7.8%
B. 13.8%
C. 17.4%
D. 14.9%
4.下列是小明“配制50g溶質質量分數為20%的氯化鈉溶液”的實驗過程。正確的是( )
A. 計算需要氯化鈉10g、水40g
B. 將氯化鈉放到托盤天平右盤稱量
C. 將氯化鈉放在量筒中溶解
D. 將配制好的溶液轉移一半后,小明認為剩余溶液溶質質量分數為10%
5.下列圖示與對應的敘述相符的是( )
A.  常溫下向稀鹽酸中不斷加水
常溫下向稀鹽酸中不斷加水
B.  用兩份等質量、等溶質的質量分數的雙氧水制取氧氣
用兩份等質量、等溶質的質量分數的雙氧水制取氧氣
C.  向等質量、等溶質的質量分數的三份稀鹽酸中分別加入不同的金屬
向等質量、等溶質的質量分數的三份稀鹽酸中分別加入不同的金屬
D.  20℃時,向一定量的接近飽和的硝酸鉀溶液中加入硝酸鉀固體
20℃時,向一定量的接近飽和的硝酸鉀溶液中加入硝酸鉀固體
二、填空題
1.下表為兩種物質在不同溫度時的溶解度。
|
溫度/℃ |
|
20 |
40 |
60 |
80 |
100 |
|
溶解度/g |
KCl |
34.0 |
40.0 |
45.6 |
51.5 |
56.7 |
|
KNO? |
31.6 |
63.9 |
110 |
169 |
246 |
(1)60℃時,KCl的溶解度是g;
(2)40℃時,將30g KCl加入到50g水中,充分溶解后所得溶液是溶液(填寫“飽和”或“不飽和”);
(3)將20℃時KNO?和KCl的兩種飽和溶液升溫至60℃,則兩種溶液的溶質質量分數大小關系是:KNO?KCl(填寫“>”、“<”或“=”)。
2.配制50g質量分數為10%的氫氧化鈉溶液,下列失誤會導致所配溶液溶質質量分數偏大的是。
A.裝瓶時,有溶液灑出 B.將量筒中的水倒入燒杯時有水濺出 C.溶解時未用玻璃棒攪拌 D.。
3.A、B、C、D、E、F、G為常見的物質,其中B、E、G屬于單質,反應②是煉鐵工業中的主要反應,如圖是它們之間的相互轉化關系。請回答:

(1)寫出物質的化學式:A:B:。
(2)寫出反應①的化學方程式,
(3)C物質固態時的名稱,該固體物質在實際生活中的一種用途是。
(4)上圖轉化中產生無色氣體G的原因是。
4.水是人及一切生物生存所必需的,為了人類和社會經濟的可持續發展,我們應該了解一些有關水的知識。請你回答:
(1)天然水中含有許多雜質,可利用吸附、沉淀、過濾和蒸餾等方法凈化,其中凈化水程度最高的方法是;除去水中難溶性固體雜質的操作是, 此操作中要用到玻璃棒,其作用是。
(2)生活中可以采用區分硬水和軟水,可以通過加入來吸附水中有異味的物質。
(3)如圖是電解水實驗裝置。下列關于電解水實驗的敘述中,正確的是(填序號)。

A.該實驗可證明水由氫元素和氧元素組成
B.試管a中收集的氣體是氧氣
C.試管a和試管b中收集的兩種氣體的質量比是2:1
D.在水中加少量稀硫酸可增強水的導電性
(4)用氯化鈉固體加水溶解,配制50g質量分數為6%的氯化鈉溶液的過程中,若量取水時俯視讀數,其他操作正確,則配制的氯化鈉溶液中溶質質量分數(選填“變大”、“變小”或“不變”)。若用上述配好的6%的氯化鈉溶液(密度為1.04g/cm3)來配制50g質量分數為3%的氯化鈉溶液,需要其體積為(計算結果精確到0.1)。
三、按要求做題
1.配制100g溶質質量分數為20%的稀硫酸,需98%的濃硫酸(密度為1.84g/cm3)的體積和水的質量分別是多少?(計算結果保留一位小數)
2.有碳酸鎂與氧化鎂的混合物共重12.4克,把該混合物加入到192克稀鹽酸中恰好完全反應,稱得反應后溶液的質量為200克。試計算反應后所得溶液中溶質的質量分數。(寫出具體計算過程)
設原混合物中MgCO?的質量為x,與鹽酸反應生成MgCl?的質量為y。
MgCO?+2HCl═MgCl2+H?O+ CO?↑
84 95 44
x y 4g
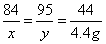
x=8.4g y=9.5g
則氧化鎂質量為12.4g﹣8.4g=4g
設MgO與鹽酸反應生成MgCl?的質量為z。
MgO+2HCl═MgCl?+H?O
40 95
4g z
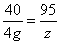
z=9.5g
∴反應后所得溶液中溶質的質量=9.5g+9.5g=19g。
∴則反應后所得溶液中溶質的質量分數為=
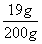 ×100%═9.5%。
×100%═9.5%。答:反應后所得溶液中溶質的質量分數是9.5%。

此內容正在抓緊時間編輯中,請耐心等待
王老師
女,中教中級職稱
專業技能突出,經驗豐富,多次獲年級和學校好評。

























